Bạn đã học lớp 9, xin chúc mừng, à quên xin chia bi thương vì chúng ta sắp phải đương đầu với kỳ thi lên cấp 3. Vào thời đại ngày nay, nó cũng đặc trưng chẳng kém gì thi đại học là mấy đâu. Nếu như khách hàng không vào được ngôi trường công lập thì sao, nếu bạn nghĩ là chẳng sao cả thì không nên đọc tiếp!
Học trường tư thì thân phụ mẹ bạn sẽ phải đóng chi phí khóa học cả trăm triệu 1 năm đó. Chưa hết nếu gần như đứa ngôi trường công nó đều giỏi giống hệt thì nó sẽ kéo nhau lên. Còn đa số đứa dại dột học cùng cả nhà thì đã kéo nhau xuống đó nha. Học xuất sắc môn hóa để giúp đỡ bạn một trong những phần sức mạnh, để giỏi môn này bạn cần am hiểu thật cẩn thận về tấm biển tuần hoàn hóa học lớp 9 này!
Bảng tuần hoàn hóa học lớp 9 là gì?
-
Nếu nghỉ ngơi lớp 8 chúng ta chỉ học dòng bảng trăng tròn nguyên tố thôi. Thì cái bảng ở lớp 9 đang có khá đầy đủ 118 yếu tố hóa học đã biết rồi, chớ hét lên như thế. Bạn chưa phải học hết toàn bộ đâu, bạn nên làm học các nguyên tố không còn xa lạ thôi như Fe, O, C, N, K, Na, Mg, Cu…
Học thuộc những nhóm chủ yếu như sắt kẽm kim loại kiềm (1a), sắt kẽm kim loại kiềm thổ (2a), halogen (7a), khí thi thoảng (8a)… các đặc thù hóa học, đồ dùng lý, hóa trị cùng số electron lớp ngoài cùng của các nhóm đặc trưng này.
Bạn đang xem: Bảng tuần hoàn nguyên tố hóa học lớp 9
Bạn cũng buộc phải học thuộc về những hàng của bảng. Chúng được hotline là chu kỳ, tất cả 3 chu kỳ bé dại (ít nguyên tố hơn) cùng 4 chu kỳ lớn (32 nguyên tố).
Bạn cũng bắt buộc học các suy ra tính chất hóa học tập của một nguyên tố khi biết vị trí của chúng trong bảng tuần hoàn. Bảng tuần hoàn sắp đến xếp những nguyên tố làm sao cho các tính chất, điểm sáng của chúng tái diễn theo những hàng với cột. Cũng chính vì thế các cột cùng hàng thường sẽ có cái gì đó giống nhau mà chúng ta phải học tập thuộc.
Nói nắm lại, sách lớp 9 dành riêng hẳn một chương năm tiết học để dạy dỗ về cái bảng này. Nên nếu khách hàng không để ý đến nó thì sẽ khá khó khăn đấy. Nếu bạn muốn hiểu hơn về bảng tuần trả thì hãy tìm hiểu thêm các bài viết của tôi nhé!
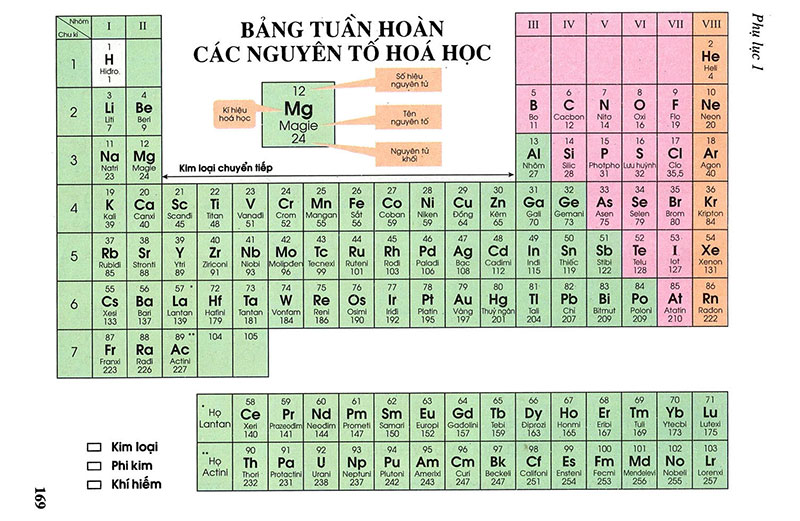
Bảng tuần hoàn hóa học lớp 9
Bạn hoàn toàn có thể tải phiên bản rõ nét rộng TẠI ĐÂY
Định khí cụ tuần hoàn hiện tại đại:
Tính chất của những nguyên tố là một hàm tuần hoàn số nguyên tử của chúng. Điều này có nghĩa là nếu các nguyên tố được sắp xếp theo đồ vật tự số nguyên tử tăng dần, thì các tính chấtsẽ được lặp lại sau một khoảng đều đặn. Bảng tuần hoàn dựa trên định mức sử dụng này được điện thoại tư vấn là bảng tuần hoàn hiện nay đại.
Mô tả của bảng tuần hoàn hóa học lớp 9:
Trong bảng tuần trả này, những nguyên tố được thu xếp theo trang bị tự số hiệu nguyên tử tăng dần.
Có bảy chu kỳ, chu kỳ trước tiên chứa nhị phần tử, chu kỳ thứ hai với thứ ba mỗi chu kỳ có 8 gọi là chu kỳ luân hồi ngắn. Chu kỳ tiếp theo sau được hotline là những chu kỳ dài.
Bảng có 18 cột dọc, nhưng mà số đội chỉ bao gồm 16. Điều này là do nhóm VIII có tía cột dọc.
Ưu điểm của bảng tuần hoàn chất hóa học lớp 9
Bảng tuần hoàn hiên đại dựa vào thuộc tính cơ phiên bản nhất, số nguyên tử của nguyên tố, trong khi bảng tuần trả của Mendeleev dựa trên trọng lượng nguyên tử của chúng.
Trong bảng tuần trả của Mendeleev, có một số điểm bất thường. Ví dụ: vị trí của các đồng vị, sai đơn lẻ tự cân nặng nguyên tử của một số trong những nguyên tố… sống bảng tuần hoàn bắt đầu các dị kì này bị loại bỏ.
Trong bảng tuần hoàn lớp 9, các nhóm bé A và B bóc biệt cụ thể vì các nguyên tố trực thuộc nhóm con B có đặc điểm hơi không giống nhau. Trong bảng tuần hoàn của Mendeleev những nhóm được giữ phổ biến với nhau.
Lên lớp 9 hóa học họ sẽ học tập gì?
Chương 1: các Loại Hợp chất Vô Cơ
Chương 2: Kim Loại
Chương 3: Phi Kim, qua loa Về Bảng Tuần Hoàn những Nguyên Tố Hóa Học
Chương 4: Hidrocacbon Nhiên Liệu
Chương 5: Dẫn Xuất Của Hidrocacbon Polime
Có thể thấy chương trình học hóa học bước đầu phức tạp rộng khi học viên phải có tác dụng quen cùng với kim loại, phi kim, nhiên liệu và polime. Khi đó các bạn sẽ phải có tác dụng quen nhiều hơn với các nguyên tố mới trong bảng tuần hoàn. Bảng tuần hoàn chất hóa học lớp 9 bước đầu phức tạp và nhiều color hơn rồi.
I. NGUYÊN TẮC SẮP XẾP CÁC NGUYÊN TỐ vào BẢNG TUẦN HOÀN
Các thành phần trong bảng tuần hoàn được bố trí theo chiều tăng đột biến của năng lượng điện hạt nhân nguyên tử.
II. CẤU TẠO BẢNG TUẦN HOÀN
1. Ô nguyên tố
- Ô nguyên tố đến biết: Số hiệu nguyên tử, kí hiệu hóa học, thương hiệu nguyên tố, nguyên tử khối của nhân tố đó.

- Số hiệu nguyên tử có số trị bởi số đơn vị điện tích phân tử nhân và ngay số electron trong nguyên tử. Số hiệu nguyên tử trùng cùng với số thiết bị tự ô vào bảng tuần hoàn.
Ví dụ: Ô sản phẩm công nghệ 11, xếp thành phần natri (Na).
Ta có:
+ Số hiệu nguyên tử = số proton = số electron = 11
+ Kí hiệu hóa học: Na
+ tên nguyên tố: natri
+ Nguyên tử khối: 23
2. Chu kì
- Chu kỳ là dãy những nguyên tố mà lại nguyên tử của chúng bao gồm cùng số lớp electron cùng được xếp theo chiều điện tích hạt nhân tăng dần.
- Số đồ vật tự chu kì bằng số lớp electron.
- Bảng tuần hoàn gồm bao gồm 7 chu kỳ: chu kỳ luân hồi 1, 2, 3 là các chu kỳ nhỏ. Chu kỳ 4, 5, 6, 7 là những chu kỳ lớn.
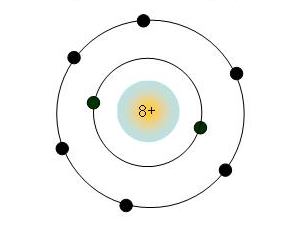
- Nhóm gồm các nguyên tố mà nguyên tử của chúng bao gồm số electron lớp bên ngoài cùng bằng nhau, cho nên vì vậy có tính chất tựa như nhau được xếp thành một cột theo chiều tăng của điện tích hạt nhân nguyên tử.
- Số thiết bị tự của những nhóm A thông qua số electron ở lớp ngoài cùng của nguyên tử trong team đó.
Ví dụ:
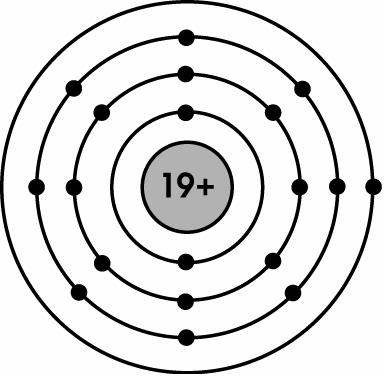
+ đội IA: Gồm các nguyên tố kim loại chuyển động mạnh. Nguyên tử của bọn chúng đều có một electron ở lớp bên ngoài cùng. Điện tích hạt nhân tăng từ bỏ Li (3+), … mang đến Fr (87+).
+ tế bào phỏng cấu tạo nguyên tử Kali ở nhóm IA, có một electron ở phần ngoài cùng:
III. SỰ BIỂN ĐỔI TÍNH CHẤT CỦA CÁC NGUYÊN TỐ vào BẢNG TUẦN HOÀN
1. Vào một chu kì
- trong một chu kỳ, lúc đi từ trên đầu đến cuối chu kỳ luân hồi theo chiều tăng của điện tích hạt nhân:
+ Số e phần bên ngoài cùng của nguyên tử tăng dần từ 1 đến 8 electron.
+ Tính kim loại của các nguyên tố giảm dần, đồng thời tính phi kim của những nguyên tố tăng dần.
Ví dụ:
Chu kì 2 bao gồm 8 nguyên tố:
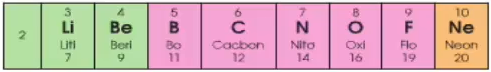
+ Số e lớp bên ngoài cùng của nguyên tử những nguyên tố trong chu kỳ 2 tăng dần từ một đến 8
+ Đẩu chu kỳ 2 là 1 kim loại to gan (Li), cuối chu kỳ là 1 trong những phi kim mạnh (F), dứt chu kỳ là 1 trong khí hiếm (Ne).
2. Trong một nhóm
Trong một nhóm, khi đi từ trên xuống bên dưới theo chiều tăng của năng lượng điện hạt nhân.
- Số lớp electron của nguyên tử tăng dần.
- Tính kim loại của những nguyên tố tăng dần, đồng thời tính phi kim của các nguyên tố sút dần.
Ví dụ: Nhóm IA có 6 nhân tố từ Li đến Fr
+ Số lớp electron tăng ngày một nhiều từ 2 cho 7. Số electron lớp ngoài cùng của nguyên tử đều bằng 1.
+ Tính kim loại của những nguyên tố tăng dần. Đầu team IA, Li là kim loại vận động hóa học mạnh mẽ cuối nhóm là kim loại Fr vận động hóa học hết sức mạnh
IV. Ý NGHĨA CỦA BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC
1. Biết địa chỉ của nguyên tố ta có thể suy đoán cấu trúc nguyên tử và tính chất của nguyên tố.
Ví dụ:
Biết: Nguyên tố A gồm số hiệu nguyên tử là 17, chu kì 3, team VIIA.
Xác định được:
+ nguyên tố A có số hiệu nguyên tử là 17, suy ra điện tích hạt nhân của nguyên tử A là 17+, nguyên tử A gồm 17 electron.
+ A ở chu kì 3, suy ra nguyên tử A gồm 3 lớp electron. Vì ở sát cuối chu kì 3 cần A là một trong những phi kim mạnh, tính phi kim của A khỏe khoắn hơn của yếu tố trước nó trong thuộc chu kì (là S bao gồm số hiệu là 16).
+ A ở đội VIIA nên lớp bên ngoài cùng có 7 electron, tính phi kim của A yếu hơn của nguyên tố bên trên nó trong cùng nhóm (là F có số hiệu nguyên tử là 9) nhưng khỏe mạnh hơn nguyên tố đứng dưới nó trong thuộc nhóm (là Br có số hiệu nguyên tử là 35).
2. Biết cấu tạo nguyên tử của nguyên tố rất có thể suy đoán địa chỉ và đặc điểm nguyên tố đó.
Xem thêm: Review son black rouge color lock heart tint h04 almond berry
Ví dụ:
Biết: Nguyên tố X tất cả điện tích phân tử nhân là 11+, nguyên tử X có 3 lớp electron, phần ngoài cùng có một electron.