Bảng nguyên tố hóa học lớp 8 có ý nghĩa vô cùng đặc trưng trong chương trình đào tạo bộ môn Hóa học. Có rất nhiều nguyên tố không giống nhau trong bảng, từng nguyên tố hoặc đội nguyên tử sẽ sở hữu những hóa trị riêng. Thuộc tham khảo nội dung bài viết dưới trên đây để biết thêm về nguyên tố hóa học lớp 8 nhé.
Bạn đang xem: Bảng nguyên tố hóa học lớp 8
1. Bảng Nguyên Tố hóa học Lớp 8 – Hóa trị của một số trong những chất thường xuyên gặp
Bảng nguyên tố hóa học 8 tất cả có những thông tin về Số Proton, tên, ký hiệu hóa học, nguyên tử khối với hóa trị của nguyên tố nuốm thể. Trong bảng sẽ bao gồm 30 nguyên tố chất hóa học thường xuất hiện thêm trong chương trình học chất hóa học lớp 8. Vậy nguyên tố hóa học lớp 8 là gì? Hóa trị của một vài chất thường gặp gỡ là bao nhiêu?

Hóa trị của nhóm nguyên tử trong bảng nguyên tố hóa học lớp 8.
3. Bài bác ca hóa trị – Mẹo nhớ cấp tốc hóa trị của những nguyên tố chất hóa học lớp 8
Phần béo học sinh đều cảm thấy khó khăn trong vấn đề ghi lưu giữ hóa trị lúc được học tập về bảng nguyên tố chất hóa học lớp 8. Mặc dù nhiên, có tương đối nhiều mẹo để giúp họ học lưu giữ một cách đơn giản và dễ hiểu thông qua các bài ca hóa trị. Dưới đây là 1 bài xích ca hóa trị thông dụng mà các chúng ta có thể tham khảo:
“Kali, Iot, Hidro
Natri cùng với Bạc, Clo một loài
Có hóa trị một các bạn ơi
Nhớ ghi cho rõ kẻo rồi phân vân
Magie, Chì, Kẽm, Thủy ngân
Canxi, Đồng ấy cùng tương đương Bari
Cuối thuộc thêm chú Oxi
Hóa trị nhị ấy bao gồm gì khó khăn
Bác Nhôm hóa trị tía lần
Ghi sâu trí nhớ khi cần phải có ngay
Cacbon, Silic này đây
Là hóa trị bốn không ngày như thế nào quên
Sắt kia nhắc cũng quen thuộc tên
Hai, cha lên xuống thiệt phiền lắm thay
Nitơ trắc trở nhất đời
Một, hai, ba, tư khi do đó năm
Lưu huỳnh lắm lúc chơi khăm
Lúc hai, lúc ba khi nằm sản phẩm công nghệ tư
Photpho nói tới không dư
Nếu ai hỏi đến thì ừ rằng năm
Bạn ơi cố gắng học chăm
Bài ca hóa trị xuyên suốt năm siêu cần.”
4. Kết luận
Bài viết trên trên đây của cửa hàng chúng tôi nhằm cung ứng thêm những kiến thức và kỹ năng hữu ích về bảng nguyên tố hóa học lớp 8. Để gồm một nền tảng vững chắc về môn Hóa học, các bạn học sinh buộc phải hiểu cùng học thuộc số đông hóa trị thuộc nguyên tử khối của những nguyên tố thường gặp mặt cùng đội nguyên tử trên.
Chúc các bạn đọc sẽ có trải nghiệm tuyệt đối hoàn hảo khi tham khảo bài viết này!
=>> các bạn hãy theo dõi kiến Guru để update bài giảng cùng kiến thức các môn học tập khác nhé!
Bảng tuần hoàn các nguyên tố hóa học là một trong những chuyên đề trọng điểm của môn hóa học trong lịch trình trung học cơ sở và trung học phổ thông. Tuy nhiên để chúng ta ghi nhớ cùng áp dụng xuất sắc bảng tuần hoàn những nguyên tố rất cần phải cần cho một phương thức học hay. Sau đấy là tổng hòa hợp bảng tuần hoàn những nguyên tố hóa học 8 9 10 tiên tiến nhất cùng phương pháp học hiệu quả.
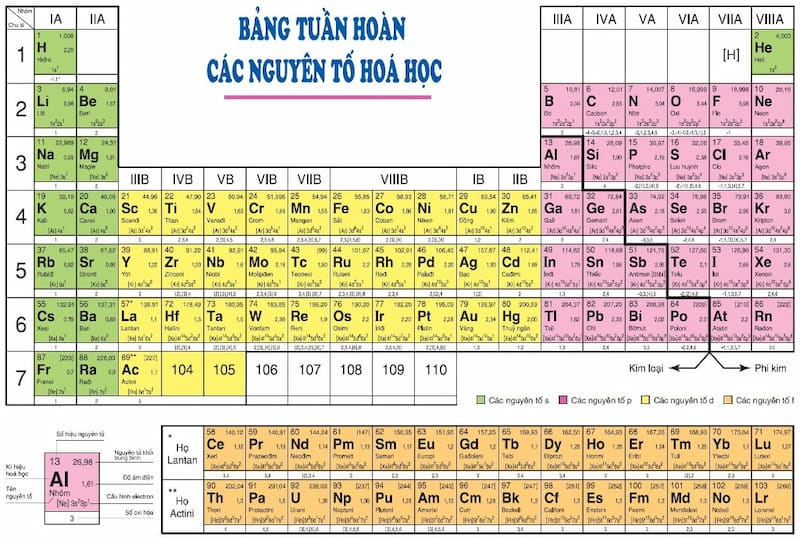
Lịch sử phát minh sáng tạo bảng tuần hóa các nguyên tố hóa học
Bảng tuần hóa những nguyên tố hóa học trải qua các cột mốc định kỳ sử đặc biệt sau đây:
Từ thời Trung cổ, con bạn đã biết đến những nguyên tố vàng, bạc, đồng, chì, sắt, thuỷ ngân, lưu giữ huỳnh.
1869, 63 yếu tắc được tìm kiếm ra, nhưng các nhà kỹ thuật vẫn chưa lý giải được quan hệ giữa chúng.
1817, J. Dobereiner thừa nhận thấy khối lượng nguyên tử của stronti nghỉ ngơi giữa cân nặng nguyên tử của bari với canxi, bộ ba nguyên tố đầu tiên này có tính chất tương tự nhau.
1862, bên địa hóa học Pháp De Chancourtois đã sắp đến xếp các nguyên tố hoá học tập theo chiều tăng của khối lượng nguyên tử lên một bằng giấy. Ông phân biệt tính chất của những nguyên tố hệt như tính chất của các con số, cùng chúng lặp lại sau mỗi 7 nguyên tố.
1864, nhà Hóa học tập Anh John Newlands sẽ tìm ra quy luật: mỗi nguyên tố đều thể hiện tính chất tương tự như như nguyên tố sản phẩm 8 khỉ xếp theo trọng lượng nguyên tử tăng dần.
1869, nhà chưng học bạn Nga Dmitri Mendeleev đã công bố bạn dạng “bảng tuần hoàn những nguyên tố hoá học” đầu tiên. Công ty khoa học bạn Đức Lothar Mayer đã và đang đưa ra một bảng tuần hoàn những nguyên tố hoá học giống như năm 1870.
Việc phát hiện định nguyên lý tuần hoàn này đã khai thác được kín đáo của quả đât vật chất, khiến cho các công ty hóa học dành được một vũ khí dạn dĩ mẽ, có ý nghĩa quan trọng với sự cải cách và phát triển của các ngành quang đãng học đồ vật lý học tập nguyên tử sau này.
Tính cho tháng 9 năm 2021, bảng tuần hoàn hóa học có toàn bộ 118 nguyên tố đã được xác nhận, bao hàm các nguyên tố từ một (Hidro) cho tới 118 (Oganesson).
Nguyên tắc sắp tới xếp những nguyên tố vào bảng tuần trả hóa học
Trong bảng tuần hoàn những nguyên tố hoá học, các nguyên tố được bố trí theo 3 chính sách như sau:
Nguyên tắc 1: các nguyên tố xếp theo chiều tăng dần đều của năng lượng điện hạt nhân nguyên tử.
Nguyên tắc 2: những nguyên tố giống nhau về lớp electron vào nguyên tử được xếp thành một hàng.
Nguyên tắc 3: những nguyên tố bao gồm cùng số electron hóa trị trong nguyên tử được sắp tới xếp vào trong 1 nhóm. Electron hóa trị là rất nhiều electron có công dụng tham gia hình thành links hóa học tập (electron phần ngoài cùng hoặc phân lớp kế ngoài cùng không bão hòa).
Cấu sản xuất của bảng tuần hoàn các nguyên tố hóa học
Hiện tại, bảng khối hệ thống tuần hoàn hóa học đã hoàn thành với 118 nguyên tố. Những nguyên tố sẽ tiến hành sắp xếp tự trái qua phải, từ trên xuống bên dưới theo quy phương tiện thứ tự tăng mạnh số hiệu nguyên tử. Vậy kết cấu của bảng tuần hoàn các nguyên tố hóa học gồm bao hàm gì?
Ô nguyên tố
Mỗi nguyên tố chất hóa học được xếp vào một trong những ô của bảng call là ô nguyên tố. Số sản phẩm công nghệ tự của ô nguyên tố thông qua số hiệu nguyên tử của yếu tố đó.
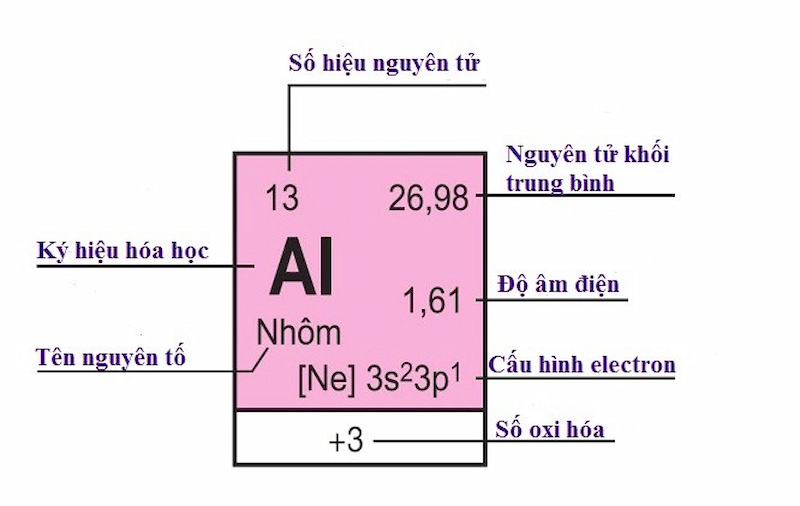
Ví dụ:
Nhôm (Al) chiếm phần ô 13 vào bảng tuần hoàn, vậy:
Số hiệu nguyên tử của Al là 13, số đơn vị chức năng điện tích phân tử nhân là 13.
Số đơn vị chức năng điện tích phân tử nhân là 13
Trong phân tử nhân có 13 proton cùng vỏ nguyên tử của Al có 13 e.
Chu kì
Chu kì là dãy các nguyên tố nhưng mà nguyên tử của chúng có cùng số lớp electron, được bố trí theo chiều năng lượng điện hạt nhân tăng dần. Vào bảng tuần hoàn tất cả 7 chu kỳ:
Chu kì 1: có 2 yếu tố H (Z=1) cho He (Z=2).
Chu kì 2: Gồm 8 thành phần Li (Z=3) mang lại Ne (Z=10).
Chu kì 3: Gồm 8 nguyên tố na (Z=11) mang lại Ar (Z=18).
Chu kì 4: bao gồm 18 thành phần K (Z=19) cho Kr (Z=36).
Chu kì 5: bao gồm 18 yếu tố Rb (Z=37) mang đến Xe (Z=54).
Chu kì 6: Gồm 32 nguyên tố Cs (Z=55) mang lại Rn (Z=86).
Chu kì 7: Bắt đầu từ thành phần Fr (Z=87) mang đến nguyên tố tất cả Z=110, đây là một chu kì không hoàn thành.
Phân loại chu kì
Chu kì nhỏ: những chu kì 1,2,3.
Chu kì lớn: Các chu kì 4,5,6,7.
Như vậy, chu kỳ luân hồi được bắt đầu bằng 1 kim loại kiềm và kết thúc bằng 1 khí hiếm. Số trang bị tự của chu kỳ luân hồi bằng số lớp electron trong nguyên tử.
Lưu ý: Hai hàng cuối bảng là 2 chúng ta nguyên tố có thông số kỹ thuật e đặc biệt:
Họ Lantan: Gồm 14 nguyên tố lép vế La(Z=57) thuộc chu kì 6.
Họ Actini: có 14 nhân tố sau Ac(Z=89) nằm trong chu kì 7.
hóa học là gì? Hóa học tất cả vai trò ra sao trong cuộc sống?
Định pháp luật bảo toàn khối lượng: Khái niệm, ngôn từ và áp dụng
Quy tắc hóa trị là gì? vận dụng quy tắc hóa trị như thế nào?
Nhóm nguyên tố
Nhóm nguyên tố là tập hợp các nguyên tố nhưng mà nguyên tử có cấu hình electron giống như nhau, do đó có đặc điểm hóa học tương tự nhau và được thu xếp thành một cột.
Bảng tuần hoàn các nguyên tố hóa học được phân loại thành 8 nhóm A (đánh số từ bỏ IA mang đến VIIIA) với 8 team B (đánh số trường đoản cú IB mang lại VIIIB). Trong đó, mỗi nhóm là một trong cột, riêng nhóm VIIIB gồm 3 cột. Nguyên tử các nguyên tố trong cùng một tổ có số electron hóa trị đều bằng nhau và thông qua số thứ tự của nhóm (trừ nhị cột cuối của group VIIIB).
Nhóm A:Nhóm A bao gồm 8 nhóm từ IA mang lại VIIIA.
Các nguyên tố đội A gồm nguyên tố s với nguyên tố p:
Nguyên tố s: Nhóm IA (nhóm kim loại kiềm, trừ H) cùng nhóm IIA (kim loại kiềm thổ).Nguyên tố p: Nhóm IIIA mang đến VIIIA (trừ He).STT nhóm bằng số e phần ngoài cùng và thông qua số e hóa trị
Cấu hình electron hóa trị tổng quát của group A:
⟶ nsanpb
⟶ ĐK: 1≤a≤2; 0≤b≤6
Số sản phẩm tự của nhóm A=a+b
⟶ ví như a+b≤3 &r
Arr; Kim loại
⟶ trường hợp 5≤a+b≤7 &r
Arr; Phi kim
⟶ trường hợp a+b=8 &r
Arr; Khí hiếm
Ví dụ:
⟶Na(Z=11):1s22s22p63s1&r
Arr;IA
⟶O(Z=8):1s22s22p4&r
Arr;VIA
Nhóm B gồm 8 nhóm được viết số từ IIIB cho VIIIB, IB cùng IIB theo hướng từ trái sang nên trong bảng tuần hoàn.
Nhóm B chỉ gồm những nguyên tố của các chu kỳ lớn.
Nhóm B gồm những nguyên tố d cùng nguyên tố f (thuộc 2 mặt hàng cuối bảng).
STT nhóm bằng số e lớp ngoài cùng và ngay số e hóa trị (Trường thích hợp ngoại lệ: Số e hóa trị = 9, 10 thuộc nhóm VIIIB)
Cấu hình electron hóa trị tổng quát của tập thể nhóm B:
⟶ (n−1)dansb
⟶ ĐK: b=2; 1≤a≤10
Số sản phẩm tự của nhóm:
⟶ giả dụ a+b 10 &r
Arr; STT nhóm = (a+b)−10
Sự biến hóa tính chất của những nguyên tố trong bảng tuần trả hóa học
Trong một chu kì (theo chiều tăng của điện tích hạt nhân) cùng trong một tổ (theo chiều từ trên xuống dưới) bao gồm sự biến đổi tính hóa học được lặp lại ở các chu kì khác, đội khác theo cùng quy lao lý dưới đây. (Như hình minh họa)
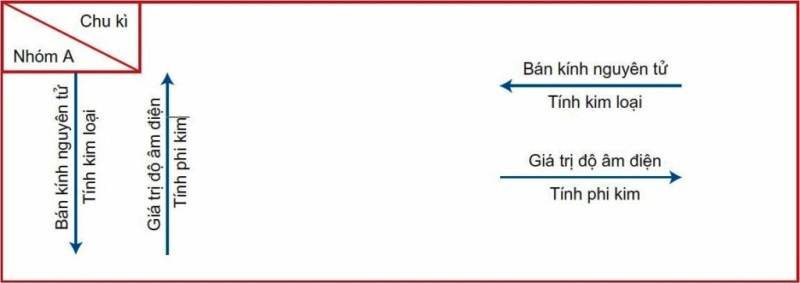
Trong một chu kì
Trong một chu kì, khi đi từ đầu chu kì mang lại cuối chu kì theo chiều tăng đột biến của năng lượng điện hạt nhân, các nguyên tố vào bảng tuần hoàn hóa học bao gồm sự chuyển đổi như sau:
Số electron lớp bên ngoài cùng của nguyên tử tăng dần từ là 1 đến 8 electron.
Tính kim loại của các nguyên tố giảm dần, đôi khi tính phi kim của các nguyên tố tăng dần. Đầu chu kì là 1 kim các loại kiềm, cuối chu kì là halogen, hoàn thành chu kì là một trong khí hiếm.
Ví dụ:
Trong chu kì 2, 3 ta dấn thấy:
Chu kì 2: gồm 8 nguyên tố.
Số electron lớp bên ngoài cùng của nguyên tử những nguyên tố vào chu kì 2 tăng dần từ một đến 8 (Li ở team I, Ne ở đội VIII).
Tính kim loại giảm dần với tính phi kim tăng dần: Đầu chu kì là 1 trong những kim loại táo bạo (Li), cuối chu kì là một trong phi kim mạnh (F), ngừng chu kì là 1 trong khí hiếm (Ne).
Ngoài ra, trong một chu kì, những nguyên tố trong bảng tuần hoàn hóa học còn có sự biến đổi tính chất:
Độ âm điện: tăng ngày một nhiều trong một chu kì, đi từ trái sang nên theo chiều tăng vọt của điện tích hạt nhân. Như vậy, độ âm điện của những nguyên tố đổi khác theo chiều tăng vọt của Z+.
(Độ âm điện của một nguyên tử là đại lượng đặc trưng cho khả năng hút electron của nguyên tử kia khi tạo thành thành link hóa học.)
Tính bazơ của những oxit với hiđroxit: sút dần theo hướng tăng của năng lượng điện hạt nhân, bên cạnh đó tính axit của bọn chúng tăng dần.
Hóa trị: Trong thuộc chu kì, khi năng lượng điện hạt nhân tăng, hóa trị cao nhất với oxi tăng từ một đến 7, hóa trị so với hidro giảm từ 4 mang lại 1. Như vậy, hóa trị tối đa của một yếu tố với oxi, hóa trị với hiđro biến đổi tuần trả theo chiều tăng của năng lượng điện hạt nhân.
Hóa trị so với hidro = số lắp thêm tự nhóm – hóa trị đối với oxi
Bán kính nguyên tử: giảm dần theo hướng tăng của năng lượng điện hạt nhân.
Năng lượng ion hóa: tăng vọt theo chiều tăng của năng lượng điện hạt nhân.
Trong một nhóm
Trong một nhóm, khi đi từ trên xuống dưới theo chiều tăng của năng lượng điện hạt nhân: Số lớp electron của nguyên tử tăng dần, tính kim loại của các nguyên tố tăng nhiều đồng thời tính phi kim của những nguyên tố bớt dần.
Ví dụ:
Trong nhóm I và nhóm VII, ta quan ngay cạnh được:
Nhóm I: có 6 nguyên tố từ Li cho Fr.
Số lớp electron tăng ngày một nhiều từ 2 cho 7.
Số electron phần ngoài cùng của nguyên tử đều bằng 1.
Tính kim loại của những nguyên tố tăng dần: Đầu nhóm, Li là sắt kẽm kim loại mạnh, mang đến cuối nhóm Fr là kim loại cực mạnh.
Nhóm VII: bao gồm 5 yếu tố từ 5 mang đến At
Số lớp electron tăng ngày một nhiều từ 2 cho 6.
Số electron phần ngoài cùng của nguyên tử đều bởi 7.
Tính phi kim sút dần: Đầu nhóm, F là phi kim vận động hoá học siêu mạnh. Đến cuối nhóm, I là phi kim hoạt động hoá học tập yếu hơn, At là nguyên tố không tồn tại trong tự nhiên nên không nhiều được nghiên cứu.
Nhóm | IA Na | IIA Mg | IIIA Al | IVA Si | VA P | VIA S | VIIA Cl |
Tính chất | Kl điển hình | Kl mạnh | Kl | Pk yếu | Pk trung bình | Pk mạnh | Pk điển hình |
Kim một số loại (Kl) | Phi kim (Pk) |
Ngoài ra, trong một tổ sắp xếp theo chiều tăng dần đều của năng lượng điện hạt nhân, những nguyên tố trong bảng tuần hoàn hóa học còn tồn tại sự biến đổi tính hóa học như sau:
Độ âm điện: giảm dần vào một nhóm, đi tự trái sang yêu cầu theo chiều tăng dần đều của điện tích hạt nhân.
Tính bazơ của những oxit cùng hiđroxit: tăng đột biến theo chiều tăng của năng lượng điện hạt nhân, đôi khi tính axit của chúng bớt dần.
Bán kính nguyên tử: tăng mạnh theo chiều tăng của điện tích hạt nhân.
Năng lượng ion hóa: giảm dần theo hướng tăng của năng lượng điện hạt nhân.
ý nghĩa đặc biệt của bảng tuần hoàn những nguyên tố hóa học
Đến năm 2021, bảng tuần hoàn các nguyên tố hóa học được hoàn thành với 118 yếu tố được xác nhận. Được biết đến là một chuyên đề quan trọng đặc biệt của lịch trình môn Hóa học tuy nhiên ít bạn biết rằng bảng tuần trả hóa học ra đời mang chân thành và ý nghĩa rất béo trong sự cải cách và phát triển của nhân loại.
Ứng dụng trong số công trình nghiên cứu: không chỉ có là một tài liệu cần thiết phục vụ trong học tập cơ mà nó còn được ứng dụng trong các công trình nghiên cứu và phân tích với kho tàng thông tin khổng lồ.
Tiền đề mang đến sự cải tiến và phát triển của nghành nghề nguyên tử: kề bên ứng dụng trong nhiều nghành nghề khác nhau, bảng tuần hoàn những nguyên tố chất hóa học đã với đang tạo ra tiền đề cho sự phát triển khỏe khoắn của nghành nguyên tử.

Cụ thể, khi biết được địa điểm của một nguyên tố với quy luật thay đổi tính chất của chúng trong bảng tuần hoàn, tự đó chúng ta có thể xác định lập cập các tin tức sau:
Cấu tạo nên của nhân tố đó và ngược lại.
Hóa trị tối đa của nguyên tố đó với Oxi cùng Hidro. Từ bỏ đó, rất có thể xác định được cách làm oxit tối đa và hidroxit tương ứng, công thức hợp chất với Hidro,...
Những tính chất hóa học cơ bản của nguyên tố đó.
Dựa vào quy luật biến đổi tính chất của những nguyên tố trong bảng tuần hoàn, ta rất có thể so sánh đặc điểm hóa học tập của một thành phần với những nguyên tố lạm cận.
Ví dụ: lưu huỳnh (S) ở phần ô số 16 trong bảng tuần trả hóa học. Tự đó, ta rất có thể xác định những thông tin quan tiền trọng:
Lưu huỳnh thuộc đội VI, chu kỳ 3 và là 1 trong phi kim.
Hóa trị cao nhất của sulfur khi kết hợp với Oxi là 6 cùng với Hidro là 2.
Công thức Oxit cao nhất của sulfur là SO3 cùng hợp chất với Hidro là H2S. Đây là một Oxit axit và axit tương xứng của nó là H2SO4 - một axit mạnh.
chất hóa học là gì? Hóa học gồm vai trò như thế nào trong cuộc sống?
Định giải pháp bảo toàn khối lượng: Khái niệm, ngôn từ và áp dụng
Cách học tập bảng tuần hoàn các nguyên tố hóa học đơn giản, dễ dàng nhớ
Bảng tuần hoàn những nguyên tố hóa học là một trong những kiến thức trọng điểm của chương trình Hóa học cung cấp 2 và cung cấp 3. Ghi ghi nhớ bảng tuần hoàn sẽ giúp bạn đạt điểm tốt trong các bài thi quan liêu trọng. Sau đó là cách học bảng tuần hoàn các nguyên tố hóa học 1-1 giản, dễ nhớ.
Cách học tập truyền thống
Với bí quyết học truyền thống cuội nguồn này, bạn có thể áp dụng hàng ngày để đạt được kết quả học tập cao nhất. Đừng quên phân chia thời hạn hợp tập phù hợp nhé!
Nhận biết nhân tố của mỗi nguyên tố: Một điều đáng lưu tâm nhất lúc sử dụng bảng tuần hoàn chất hóa học là độc giả phải phân biệt được số nguyên tử, nguyên tử khối trung bình, độ âm điện, thông số kỹ thuật e, số oxi hóa, tên nguyên tố cùng kí hiệu hóa học. Những tin tức này đều biểu hiện trong ô thành phần trong bảng tuần hoàn.
Mỗi ngày học tập thuộc 1-3 nguyên tố: Đây là một phương pháp học được vận dụng phổ biến. Để ghi nhớ một bảng tuần hoàn hơn 100 nguyên tố với các thông số đi kèm, việc phân nhỏ dại bảng nhằm học góp não bộ ghi ghi nhớ được một biện pháp hiệu quả. Cạnh bên đó, bạn nhớ là ôn lại bài bác cũ khi học những nguyên tố mới tránh sự cố quên.
Dán bảng tuần hoàn chất hóa học nơi chúng ta thường đi qua: Một phương pháp làm khá mới mẻ và lạ mắt được áp dụng để ghi lưu giữ bảng tuần hoàn chất hóa học là dán nó ở khắp mọi nơi các bạn thường đi qua. Mặt khác, bạn cũng có thể mang theo bảng tuần hoàn mặt người, trong cặp sách nhằm học khi thủng thẳng rỗi.

Sử dụng công cụ hỗ trợ trí nhớ
Sử dụng công cụ hỗ trợ trí nhớ là phương thức ghi nhớ bảng tuần hoàn các nguyên tố được những thầy cô và học viên sử dụng tương đối rộng rãi. Vắt vì phải nhớ thương hiệu của từng nguyên tố, hãy thực hiện một vài ba mẹo ghi nhớ dễ dãi thông qua các câu nói dễ thuộc sau:
“Khi nào bắt buộc may áo gần kề sắt lưu giữ sang phố hỏi shop Á Phi Âu”: Đây là câu nói tới để ghi nhớ 16 nguyên tố chất hóa học trong dãy chuyển động hóa học. Tên các nguyên tố được “biến thể” linh hoạt dựa vào những chữ cái đầu tiên, tương ứng với: F, Na, Ca, Mg, Al, Zn, Fe, Ni, Sn, Pb, H, Cu, Hg, Ag, Pt, Au.
“Lâu nay không thư thả coi phim”: Câu nói thân thuộc giúp ghi nhớ 6 yếu tắc hóa học team IA: Li, Na, K, Rb, Cs, Pr.
Bài ca hóa trị cơ bản được truyền miệng rộng rãi:
Kali (K), Iot (I), Hidrô (H)
Natri (Na) với bạc bẽo (Ag), Clo (Cl) một loài
Là hoá trị một (I) em ơi
Nhớ ghi cho kỹ kẻo thời phân vân
Magiê (Mg), Kẽm (Zn) với Thuỷ Ngân(Hg)
Oxi (O), Đồng (Cu), Thiếc(Sn) cùng gần Bari (Ba)
Cuối thuộc thêm chú can xi (Ca)
Hoá trị hai (II) nhớ gồm gì cực nhọc khăn
Bác Nhôm (Al) hoá trị ba(III) lần
In sâu đầu óc khi cần phải có ngay
Cacbon (C), Silic (Si) này đây
Có hoá trị bốn(IV) ko ngày như thế nào quên
Sắt (Fe) tê lắm cơ hội hay phiền
Hai, ba lên xuống nhớ ngay lập tức ngay thôi
Nitơ (N) rắc rối nhất đời
Một hai tía bốn, khi thời lên V
Lưu huỳnh (S) lắm lúc chơi khăm
Xuống hai lên sáu lúc nằm thiết bị tư
Phot pho (P) nói tới không dư
Có ai hỏi cho thì ừ rằng năm
Em ơi, nỗ lực học chăm
Bài ca hoá trị xuyên suốt năm yêu cầu dùng.
Chơi trò chơi
Bên cạnh phương thức học truyền thống lâu đời cùng mẹo ghi ghi nhớ thú vị, chơi các trò nghịch trực đường cũng là 1 trong cách ghi nhớ những nguyên tố chất hóa học hiệu quả! phần nhiều trò chơi kỹ năng này rất có thể kiểm tra tâm trí và nâng cấp điểm số của người tiêu dùng đáng nói trước số đông kỳ thi đặc trưng đó!
Cách ghi ghi nhớ bảng tuần hoàn những nguyên tố hóa học
Bên cạnh các cách thức học tập trên, cách thức học thuộc cấp tốc và vận dụng thành thành thục bảng tuần hoàn các nguyên tố hóa học là thường xuyên giải những bài tập về hóa học, phân tích sâu các nguyên tố hóa học.
Hãy phân tích sâu với xác định thực chất các thành phần khác nhau của từng nguyên tố hóa học. Ghi nhớ cùng thành thành thạo 10 nguyên tố thứ nhất trong bảng (tất cả những thông tin bao gồm trong ô), bạn sẽ tự tìm ra quy luật cho các giá trị nhân tố tiếp theo. Hãy sử dụng phương thức so sánh với mức giá trị sẽ học. Từ từ như vậy, các bạn sẽ nắm được hết tin tức về rộng 120 nhân tố trong bảng tuần trả Mendeleev. hueni.edu.vn chúc các bạn áp dụng được phương thức học hiệu quả nhất và dành được điểm cao vào kỳ thi!

Bài tập về bảng tuần hoàn các nguyên tố chất hóa học SGK chất hóa học 9, 10 kèm lời giải
Trên đây là tổng hợp những kiến thức về bảng tuần hoàn những nguyên tố hóa học 8 9 10 bắt đầu nhất. Hãy vận dụng những kiến thức trên nhằm giải một số bài tập hóa học 9 cùng Hóa học 10 sau:
Giải bài xích tập bảng tuần hoàn các nguyên tố chất hóa học SGK hóa học 9
Bài 1 (trang 101 SGK Hóa 9)Dựa vào bảng tuần hoàn, hãy cho biết cấu tạo nguyên tử, đặc thù kim loại, phi kim của các nguyên tố tất cả số hiệu nguyên tử 7, 12, 16.
Gợi ý đáp án:
Số hiệu nguyên tử | Cấu tạo nguyên tử | Tính chất | ||||
Điện tích phân tử nhân | Số e trong nguyên tử | Số lớp electron | Số e lớp bên ngoài cùng | Kim loại | Phi kim | |
7 | 7+ | 7 | 2 | 5 | x | |
12 | 12+ | 12 | 3 | 2 | x | |
16 | 6+ | 6 | 3 | 6 | x |
Giả sử nguyên tố A gồm số hiệu nguyên tử là 7 &r
Arr; A ở trong ô số 7 trong bảng tuần hoàn, có điện tích phân tử nhân là 7+, có 7e.
Dựa vào bảng tuần trả ta thấy: nhân tố A nằm trong chu kì 2 &r
Arr; gồm 2 lớp electron; thuộc team V &r
Arr; có 5 e lớp bên ngoài cùng với phi kim.
Tương từ bỏ với 2 nguyên tố còn sót lại ta được kết quả trong bảng.
Bài 2 (trang 101 SGK Hóa 9)Biết X có cấu trúc nguyên tử như sau: Điện tích phân tử nhân là 11+, 3 lớp electron, phần bên ngoài cùng có một electron. Hãy suy ra địa điểm của X vào bảng tuần hoàn và tính chất hoá học tập cơ bản của nó.
Gợi ý đáp án:
Điện tích phân tử nhân là 11+ đề nghị số sản phẩm công nghệ tự của nguyên tố là 11 ( ô số 11).
Có 3 lớp e &r
Arr; ở trong chu kì 3.
Có 1 e phần bên ngoài cùng &r
Arr; thuộc đội I trong bảng tuần hoàn.
Tên yếu tố là: Natri.
Kí hiệu hóa học: Na.
Nguyên tử khối: 23.
Bài 3 (trang 101 SGK Hóa 9)Các thành phần trong đội I hầu hết là những sắt kẽm kim loại mạnh tựa như natri: công dụng với nước chế tạo ra thành hỗn hợp kiềm giải tỏa hiđro, công dụng với oxi sản xuất thành oxit, chức năng với phi kim khác chế tạo thành muối hạt ... Viết các phương trình hóa học minh họa với kali.
Gợi ý đáp án:
Phương trình hóa học:
Tác dụng cùng với nước tạo nên dung dịch kiềm với giải phóng khí H2
2K + 2H2O → 2KOH + H2
Tác dụng cùng với oxi sinh sản thành oxit
4K + O2 → 2K2O
Tác dụng với phi kim tạo ra thành muối
2K + Cl2 → 2KCl.
Giải bài bác tập bảng tuần hoàn những nguyên tố hóa học SGK chất hóa học 10
Giải bài xích 1 trang 35 SGK Hóa 10Các yếu tắc xếp sinh hoạt chu kì 6 gồm số lớp electron vào nguyên tử là:
A. 3.
B. 5.
C. 6.
D. 7.
Chọn đáp số đúng.
Cần nhớ: Số thiết bị tự của chu kì ngay số lớp electron. Số trang bị tự của group bằng số e hóa trị
Gợi ý đáp án: C là lời giải đúng.
Giải bài 2 Hoá 10 SGK trang 35Trong bảng tuần hoàn những nguyên tố, số chu kì nhỏ dại và số chu kì phệ là:
A. 3 và 3.
B. 3 với 4.
C. 4 cùng 4.
D. 4 cùng 3.
Chọn đáp số đúng.
Gợi ý đáp án: B là câu trả lời đúng
Giải bài 3 SGK Hóa 10 trang 35
Số yếu tắc trong chu kì 3 với 5 là:
A. 8 với 18.
B. 18 và 8.
C. 8 và 8.
D. 18 và 18.
Chọn đáp số đúng.
Gợi ý đáp án: A là câu trả lời đúng.
Giải bài xích 4 trang 35 SGK Hóa 10Trong bảng tuần hoàn, các nguyên tố được sắp xếp theo nguyên tắc:
A. Theo chiều tăng của điện tích hạt nhân.
B. Những nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành 1 hàng.
C. Các nguyên tố có cùng số electron hóa trị vào nguyên tử được xếp thành 1 cột.
D. Cả A, B, C.
Chọn câu trả lời đúng.
Gợi ý đáp án: D là giải đáp đúng.
Giải bài bác 5 Hoá 10 SGK trang 35Tìm câu sai trong những câu sau đây:
A. Bảng tuần hoàn gồm có các ô nguyên tố, các chu kì và các nhóm.
B. Chu kì là dãy các nguyên tố mà hầu như nguyên tử của chúng gồm cùng số lớp electron, được bố trí theo chiều điện tích hạt nhân tăng dần.
C. Bảng tuần hoàn gồm 7 chu kì. Số đồ vật tự của chu kì bằng số phân lớp electron trong nguyên tử.
D. Bảng tuần hoàn gồm 8 team A và 8 đội B.
Gợi ý đáp án: C là câu trả lời sai.
Giải bài bác 6 trang 35 SGK Hóa 10Hãy cho thấy thêm nguyên tắc chuẩn bị xếp những nguyên tố trong bảng tuần hoàn các nguyên tố hóa học.
Gợi ý đáp án:
a) các nguyên tố được bố trí theo chiều tăng đột biến của điện tích hạt nhân.
b) những nguyên tố bao gồm cùng số lớp electron vào nguyên tử được thu xếp thành một hàng.
Xem thêm: Bảng giá xe ford transit cũ 02/2023, mua bán xe ô tô ford transit cũ và mới
c) những nguyên tố có số electron hóa trị được xếp thành một cột.

Như vậy, bài viết này của hueni.edu.vn đã cung cấp cho bạn tổng hợp kiến thức về bảng tuần hoàn các nguyên tố hóa học 8 9 10 mới nhất cùng bí quyết ghi ghi nhớ hiệu quả. Hy vọng qua những thông tin trên, bạn có thể học ở trong lòng tác dụng bảng tuần hoàn những nguyên tố và vận dụng chúng nhằm giải thành thạo bài tập trong những kỳ thi quan lại trọng. Truy vấn website của hueni.edu.vn hàng ngày để cập nhập thêm nhiều bài học thú vị về các môn học Toán, Lý, Hóa nhé!